MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:

MLZ
Lichtenbergstr.1
85748 Garching
11.03.2021
Neutronen für bessere mRNA-Impfstoffe

Dr. Aurel Radulescu am KWS-2-Instrument in der Neutronenleiterhalle der Forschungs-Neutronenquelle Heinz Maier-Leibnitz (FRM II) in Garching. © Wenzel Schürmann / TUM
BioNTech, das Biotechnologie-Unternehmen aus Mainz, das gemeinsam mit dem US-Pharmakonzern Pfizer den ersten in der EU zugelassenen Covid-19-Impfstoff entwickelte, arbeitet bei der Impfstoffentwicklung auch mit dem Jülich Centre for Neutron Science (JCNS) zusammen. Dabei hat ein Forscherteam das Instrument KWS-2 genutzt, das das JCNS am Heinz Maier-Leibnitz Zentrum betreibt.
2020 etwa veröffentlichten die Forscherinnen und Forscher gemeinsam mit der Johannes Gutenberg-Universität Mainz und weiteren Partnern eine Studie dazu, wie sich die Effizienz des Einschleusens von mRNA in menschliche Zellen mittels optimierter Verpackung verbessern lässt. 2019 publizierten die Forscher, ebenfalls gemeinsam mit Partnern, Ergebnisse von Strukturuntersuchungen eines Modell-Systems zur Verpackung von mRNA.
mRNA-Impfstoffe nutzen „Boten-RNA“ (vom englischen „messenger RNA“). mRNA dient in menschlichen Körperzellen als Blaupause für die Synthese von Eiweißmolekülen. Sie übersetzt die Baupläne im genetischen Code, der DNA, für die molekularen Maschinen der Zellen. So können sie die Aminosäuren als Bausteine zu Eiweißen verknüpfen.
BioNTechs Corona-Impfstoff etwa enthält mRNA mit dem Bauplan des sogenannten Spike-Proteins. Darüber dockt das Virus an menschliche Zellen an. Wer mit dem mRNA-Impfstoff geimpft ist, dessen Zellen produzieren das Spike-Protein kurzzeitig, bis die mRNA auf natürlichem Weg abgebaut wird. Dann setzen die Zellen das Virusprotein frei, sodass das Immunsystem auf das körperfremde Eiweiß trainiert wird.
Impfung auch gegen Krebsarten?
Die Methode eignet sich wahrscheinlich nicht nur zur Impfung gegen Infektionskrankheiten wie Covid-19. Da sich grundsätzlich Baupläne für verschiedenste Proteine auf diese Weise in den Körper einschleusen lassen, hofft man auch darauf, dass sich auf diese Weise Immunreaktionen etwa gegen bestimmte Krebsarten erzeugen lassen.
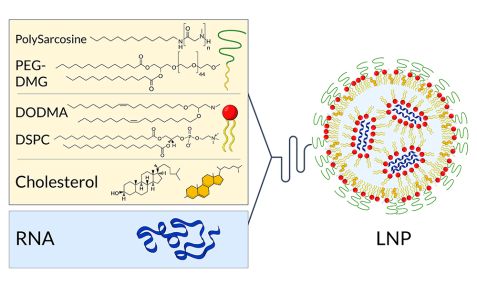
Boten-RNA erfolgreich in Zellen im Körper einzuschleusen, die sogenannte Transfektion, ist eine Herausforderung, aber entscheidend für die Wirksamkeit des Impfstoffs. Reine mRNA würde im Gewebe bereits von allgegenwärtigen Enzymen abgebaut, bevor sie von Zellen aufgenommen werden könnte. Um die wertvolle Fracht vor Schäden zu schützen, verpacken sie die Hersteller in der Regel in winzige Partikel, sogenannte Nanopartikel. Sie bestehen aus Molekülen, die denen der Zellmembran ähneln und deshalb mit diesen verschmelzen und die mRNA ins Zellinnere abgeben können.
Neutronen testen Verpackungsmaterial der mRNA
Mit Hilfe von Neutronenstreuung am KWS-2 haben die Forscherinnen und Forscher verschiedene neue Ansätze für die Verpackung und Auslieferung der mRNA untersucht. Unter anderem zeigten die Untersuchungen, dass sich die Effizienz der Transfektion durch die richtige Kombination von Materialien für den Aufbau der Nanopartikel erhöhen lässt. Besser als reine Lipid- oder reine Polymer-Nanopartikel schleusen geeignet aufgebaute Hybrid-Nanopartikel, die sowohl Lipide als auch Polymere enthielten, ihre Fracht in die Zellen, berichteten die Forscherinnen und Forscher 2020 im Fachjournal „Cells“.
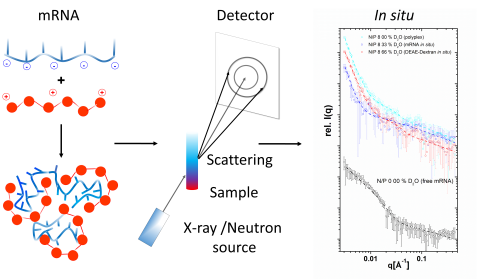
Ergebnisse der am KWS-2-Instrument gemessenen mRNA (blau)/ DEAE-Dextran (rot)-Partikel (Einzelkomponenten und vollständig „sichtbare“ Partikel). © Dr. Christian Siewert, Johannes Gutenberg University Mainz
„Strukturanalysen unter anderem am Jülicher Neutronenkleinwinkelstreuinstrument KWS-2 zeigten dabei, dass sich die höchste Transfektionseffizienz durch Partikelarten erreichen lässt, die eine heterogene innere Organisation aufweisen, bei der sich geordnete und weniger geordnete Bereiche in charakteristischer Weise abwechseln“, berichtet der JCNS-Instrumentverantwortliche Dr. Aurel Radulescu.
Hoher Neutronenfluss bietet Vorteile
Um die Partikel genauer zu untersuchen tauschten die Wissenschaftlerinnen und Wissenschaftler Wasserstoffatome einzelner Komponenten gegen schweren Wasserstoff aus. Neutronen können die beiden Isotope voneinander unterscheiden und so erkennen, welche Wasserstoffatome zu welchem Molekül gehören. „Solche Experimente erfordern einen hohen Neutronenfluss auf der Probe, was ein Hauptvorteil des KWS-2-Instruments ist“, sagt Radulescu.
Auch das Mengenverhältnis zwischen mRNA und Hüllmaterial spielt eine Rolle für die Effizienz der Transfektion: 2019 berichteten die Wissenschaftlerinnen und Wissenschaftler in der Fachzeitschrift „Biomaterials“ über das hochmolekulare Kohlenhydrat Dextran als „Verpackungsmaterial“. Diese Untersuchungen, ebenfalls unter anderem an der KWS-2, zeigten einen systematischen Zusammenhang zwischen dem Mengenverhältnis von Dextran und mRNA und der Effizienz der Transfektion auf sowie die damit verbundenen strukturellen Unterschiede der Nanopartikel.
Die Verwendung solcher Modellsysteme und die systematische Variation grundlegender Prozessschritte ermöglichen es, Korrelationen zwischen den strukturellen Eigenschaften, der biologischen Aktivität und dem Produktionsverfahren zu erkennen. Ein solches Verständnis erleichtert die weitere Entwicklung komplexer maßgeschneiderter RNA-Therapeutika und -Impfstoffe.
Originaltext: Angela Wenzik / JCNS
- Informationen der Firma BioNTech über mRNA-Therapeutika (engl.)
- Originaltext des Forschungszentrums Jülich
Original-Publikationen:
Hybrid Biopolymer and Lipid Nanoparticles with Improved Transfection Efficacy for mRNA; Christian D. Siewert, Heinrich Haas, Vera Cornet, Sara S. Nogueira, Thomas Nawroth, Lukas Uebbing, Antje Ziller, Jozef Al-Gousous, Aurel Radulescu, Martin A. Schroer, Clement E. Blanchet, Dmitri I. Svergun, Markus P. Radsak, Ugur Sahin and Peter Langguth; „Cells“, 2020; DOI: 10.3390/cells9092034
Investigation of charge ratio variation in mRNA – DEAE-dextran polyplex delivery systems; C.Siewert, H.Haas, T.Nawroth, A.Ziller, S.S.Nogueira, M.A.Schroer, C.E.Blanchet, D.I.Sverg, A. Radulescu, F.Bates, Y.Huesemann, M.P.Radsak, U.Sahin, P.Langguth; “Biomaterials”, 2019; DOI: 10.1016/j.biomaterials.2018.10.020
Kontakt:
Dr. Aurel Radulescu
Jülich Centre for Neutron Science (JCNS-FRM-II)
Forschungszentrum Jülich
Tel. 089 289-10712
E-Mail: a.radulescu@fz-juelich.de
Pressekontakt:
Angela Wenzik
Wissenschaftsjournalistin
Forschungszentrum Jülich
Tel. 02461 61-6048
E-Mail: a.wenzik@fz-juelich.de
MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien: